常用安乐死方法
一、动物安乐死的目的
动物安乐死的目的是以人道的方式结束动物的生命,使动物的疼痛、恐惧、应激程度降至最低,并在最短的时间内失去知觉和痛觉。在科学应用、教学及试验中,常因下列因素选择对实验动物执行安乐死:
1. 实验终结;
2. 因研究所需提供血液或其他组织脏器;
3. 当动物的疼痛与应激程度超出预期程度;
4. 出于动物健康和福利考量;
5. 不适合继续繁殖(育种因素)。
二、选择安乐死的药物与方法的原则
1. 避免动物在死亡之前处于疼痛、焦虑、恐惧、应激等不良状态;
2. 缩短动物从失去知觉直至死亡所耗费的时间;
3. 安乐死药物与方法的可靠性;
4. 对操作人员的安全性;
5. 不可逆性;
6. 对操作和观察人员情绪上的影响;
7. 对不同品种、年龄与健康状态的动物的适合性;
8. 对不同实验需求和目的的适合性;
9. 设备的获取及维护的便利性;
10. 对环境的影响;
11. 人滥用药物的潜在危害性。
三、常用安乐死方法
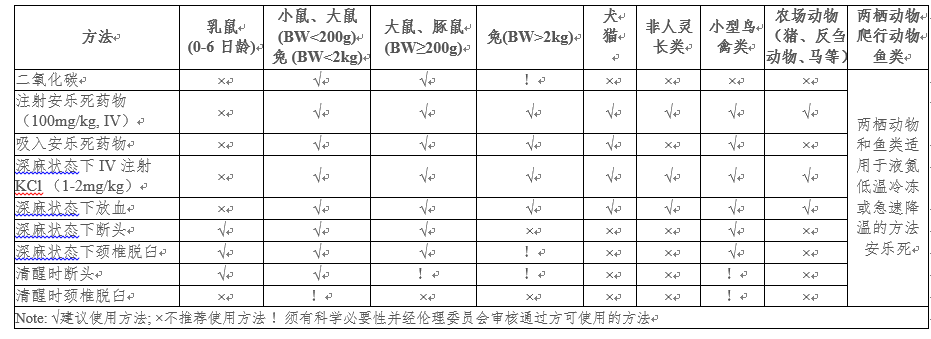
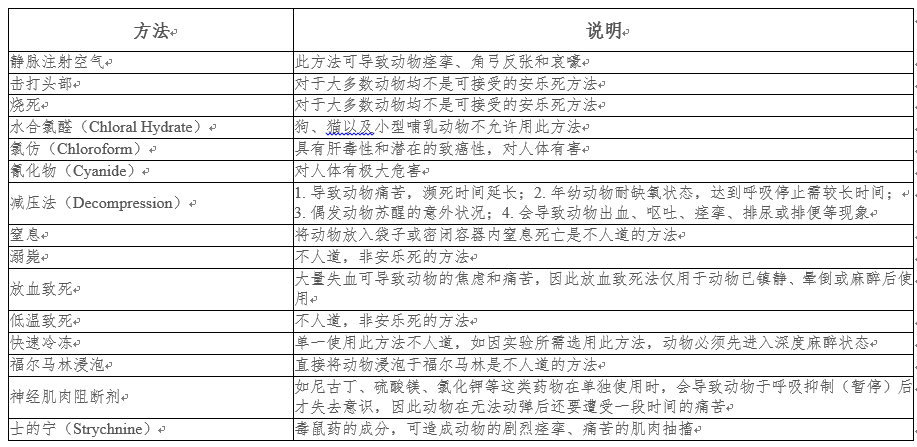
四、脊椎动物禁止使用的处死方法
五、各种安乐死方法的具体介绍
动物安乐死方法的选择取决于动物品种、大小、温驯程度、对疼痛与应激的耐受度、保定方法、研究方案中是否需要采集组织样品等。适当的物理保定方法不仅可降低动物的恐惧、焦虑及疼痛,并可保障操作人员的安全。另外,人员的技术、动物的数量同样是安乐死程序能否顺利完成的重要因素。导致动物死亡的机制有:(1)直接或间接的缺氧;(2)直接使脑神经失去机能;(3)物理性破坏脑神经,终止脑活动。
安乐死药物与方法
吸入性药物
常用药物有halothane(氟烷), isoflurane(异氟烷), enflurane(**), sevoflurane(七氟烷), 乙醚等。
吸入性药物通过汽化器或密闭容器进入动物体内,因此须具有相关的设备,密闭容器应透明以便观察动物。大部分情况下,动物快速暴露于高浓度药物中时可快速失去知觉。多数吸入性药物对人体有害,如乙醚具有易爆性、氟烷有肝损伤性、氮气和一氧化碳易导致人体缺氧、一氧化氮易致成瘾等,因此,应在通风良好的场所执行安乐死操作。刚出生的幼崽对缺氧环境的耐受度高,因此须较长的吸入时间。使用吸入性药物执行安乐死时,容器内装入的动物勿过度拥挤,且勿同时混入不同品种的动物,以免造成动物死亡前的紧张和恐惧。爬虫类、两栖类、禽类和兔子善于憋气,因此建议优先选择其他方法。

二氧化碳
空气中含有0.04%二氧化碳,较空气重,无色、无味。吸入浓度于7.5%时动物疼痛阈值上升,越高的二氧化碳浓度有越快的麻醉效果,但也有研究表明快速暴露于高浓度二氧化碳时可能导致动物的痛苦。
出生一天的雏鸡用二氧化碳安乐死效果良好,于禽类则可造成不同程度的痛苦,通常可于五分钟内达到死亡。由于禽蛋在胚胎发育时即开始呼吸,未孵化的蛋内有14%的二氧化碳,因此,对于雏鸡和其他出生幼崽,应使用高浓度的二氧化碳进行安乐死。啮齿类动物于其饲养笼内吸入二氧化碳安乐死可有助于减少动物紧张和痛苦。

非吸入性药物
多数为注射性药物,此方法可以使动物迅速死亡,使非常可靠的动物安乐死方法。须注意的是操作中避免动物遭受痛苦或恐惧,而操作人员也必须充分掌握各种给药操作。注射性药物有多种给药方法,其中静脉注射是最佳选择。药物注射前,操作人员须评估动物是否出现精神亢奋或难以控制的状态,必要时应先给予镇静剂或止痛药物,以降低动物的紧张或痛苦,并保障操作人员的安全。如动物已表现出垂死、休克或深度麻醉状态,难以顺利进行静脉注射时,可通过心脏注射。腹腔注射需使用较高剂量的药物,并且可能延长动物死亡时间,导致动物死前挣扎。因此腹腔注射后,将动物转移至小箱子或笼内,置于安静无干扰的场所。
巴比妥类药物(Barbiturates)
过量的巴比妥类药物经静脉注射给药是首选的动物安乐死方式,可抑制中枢神经反射,使动物失去知觉进入麻醉状态,过量的药物剂量可使动物停止呼吸,接着心跳停止。其中戊巴比妥钠(Pentobarbital Sodium)为最理想的动物安乐死药物,同样还有Beuthanasia-D (Burns-Biotec), Sleepaway (Fort Dodge Laboratories) 等商品化药物,但在国内,此类药物多为管制药品,获取较为困难。

水合氯醛 Chloral Hydrate

安乐死的物理方法
包括颈椎脱臼、断头、放血、击晕枪、电击等。有些操作人员抗拒并排斥物理安乐死方法,但只要具备良好的技巧并配以适当的工具,物理方法能迅速解除动物的痛苦。如未受过训练的人员贸然实施物理方法,不仅易造成人员受伤,更可能使动物未完全死亡而导致极大痛苦。有些物理方法,如放血、击晕、脑髓穿刺等,不建议作为动物安乐死的单一方法,须配合其他方法共同使用。所有操作人员应接受完整的操作技术培训,并以尸体或模型多次练习后才可正式执行。
颈椎脱臼法
常用于啮齿类动物、禽类和仔兔。通过正确的操作技巧,人员可迅速将动物的颈椎与脊椎脱离,使动物死亡。对于小型啮齿类动物,利用硬杆或拇指、食指压住头颈部,另一只手抓住尾巴或后肢,迅速用力向后上方拉扯后驱,使颈椎脱臼。对于禽类,双手抓取脖颈扭断。对于仔兔,一手抓头部,另一手抓后肢,将身体迅速拉长,使颈椎脱臼。

断头法
此方法仅适用于对小型啮齿类动物或仔兔的安乐死。此方法保证组织或体液无化学药物干扰,也可提供完整的脑部组织以供研究。断头后动物虽呈现约13-14s的脑部活性,但研究表明此时已无疼痛反应的传导,动物迅速失去意识。商品化的断头台(guillotine)可提供大鼠与仔兔的断头,而锐利的剪刀亦可用于200g以下小鼠的断头操作。

放血法
已经失去意识或击晕后的动物,配合放血方法可确保动物完全死亡。由于大量失血,动物会表现出焦虑和痛苦,因此放血不可作为安乐死的单一方法。如因研究所需采集动物血液,必须先击晕或麻醉动物后执行,且避免放血不完全导致动物苏醒。
六、执行安乐死前后的注意事项
避免造成存活动物的恐惧
动物的应激性叫声和惊恐行为、或令动物惊恐的气味等,都会引起动物的焦虑、不安和应激,这些因素会影响存活动物的身心健康和福利,干扰实验结果。因此,动物安乐死时应在远离存活动物的非公开场所执行。
安乐死设备
执行安乐死所用的药物与仪器设备,应随时保持最佳的使用状态。依据动物品种、体重及数量,事先准备好足量的药物与设备仪器,并定期维护。动物安乐死时被血液、粪尿污染的器具应及时清洗消毒,一面造成其他安乐死前动物的焦虑。
辅助安乐死的方法
动物安乐死首要考虑解除动物临死前的痛苦与焦虑,因此对于精神亢奋或难以控制的动物,应先给予相应的镇静剂或止疼药后再对其执行安乐死。
确认动物死亡
所有动物的安乐死,最终步骤须确认动物是否已经完全死亡。应检查动物的心跳是否完全停止、瞳孔是否放大。停止呼吸的单一现象不能作为判断动物是否死亡的依据,因为动物往往先停止呼吸,数分钟之后才停止心跳,在使用二氧化碳对动物进行安乐死时尤其明显。另外,兔子与禽类会憋气,因此不适用二氧化碳作为安乐死方案。
动物尸体处理
执行动物安乐死及尸体处理的人员必须了解该动物是否有人畜共患病的潜在危害、是否曾进行过放射性物质或有毒化学物质试验,必要时应有适当的人员防护措施(PPE)。